我园研究人员揭示Polycomb蛋白在成花基因调控网络的多个层面上促进花发育和花器官命运决定性

花发育过程中,Polycomb group(PcG)蛋白介导的组蛋白3赖氨酸27位的3甲基化(H3K27me3)控制着许多发育调控因子在时间和空间上表达的准确性。花分生组织中干细胞因子WUS的表观遗传沉默机制依赖于PcG蛋白介导的H3K27me3修饰。然而,在花分生组织命运决定过程中,H3K27me3介导的其他分生组织调控因子及细胞多能性调控因子的沉默机制尚未被深入研究。
近日,我园外籍研究员、PI负责人Ralf Mueller-Xing团队在Journal of Experimental Botany上发表了“Polycomb proteins control floral determinacy by H3K27me3-mediated repression of pluripotency genes in Arabidopsis thaliana”的研究论文。该研究揭示在早期花发育过程中不同基因位点PcG加载的表观遗传调控作用;通过对表观组和转录组测序结果分析鉴定出成花调控网络及其中关键的调控因子,并对这些因子进行异位表达和突变体表型分析,深入研究了其对花发育的调控机制。

重要结果如下:
① 成花诱导以后全基因组水平H3K27me3的变化
对植物材料AP1-GR ap1-1 cal-1诱导开花的第0天和5天进行H3K27me3 ChIP-Seq实验。共鉴定出420个组蛋白差异甲基化的基因,其中296个编码基因,3个miRNA和5个专座子原件。其中鉴定出的花发育或分生组织发育相关转录因子151个,分别属于MADS家族、HD家族等(图1)。
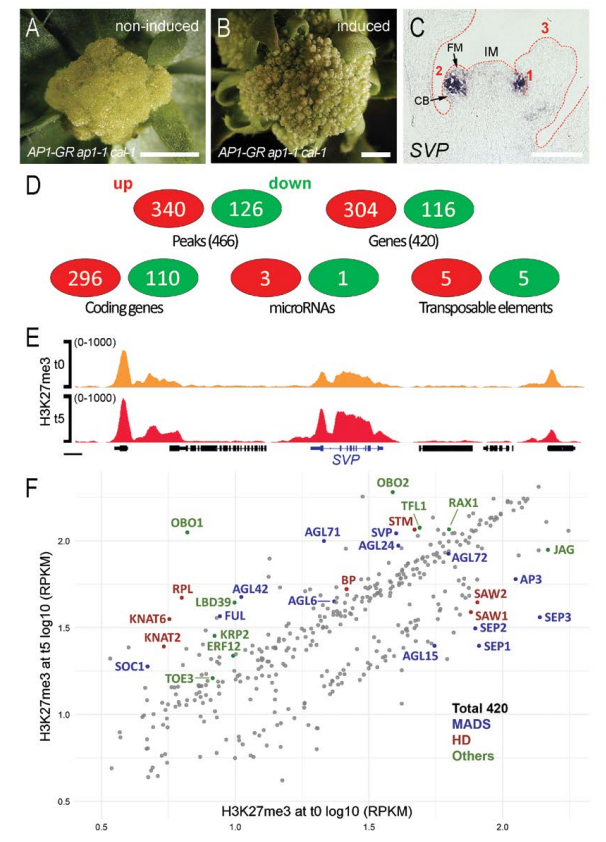
图1. AP1-GR ap1-1 cal-1成花诱导以后全基因组水平H3K27me3水平的变化。A-B,AP1-GR ap1-1 cal-1诱导开花系统;C,SVP原位杂交;D-F,AP1-GR ap1-1 cal-1诱导开花的第0天和5天进行H3K27me3 ChIP-Seq实验结果。
② 在全基因组水平分析早期花发育过程中H3K27me3水平的变化与基因表达水平变化的相关性。
ChIP-seq和RNA-seq的相关分析表明,在全基因组水平H3K27me3水平的变化与mRNA的表达具有显著负相关。Ralf Mueller-Xing小组鉴定出151个编码基因其在早期花发育过程中H3K27me3水平显著上调同时mRNA水平显著下调,其中转录因子占40.4%;49个编码基因位点H3K27me3水平显著下调同时mRNA水平显著上调,其中转录因子占26.5%。这些具有显著相关性的转录因子分别属于HD、C2H2 Zn、MADS、AP2/ERF、SRS、bHLH、DOF Zn、HD-ZIP、MYB、OBO等蛋白家族(图2)。
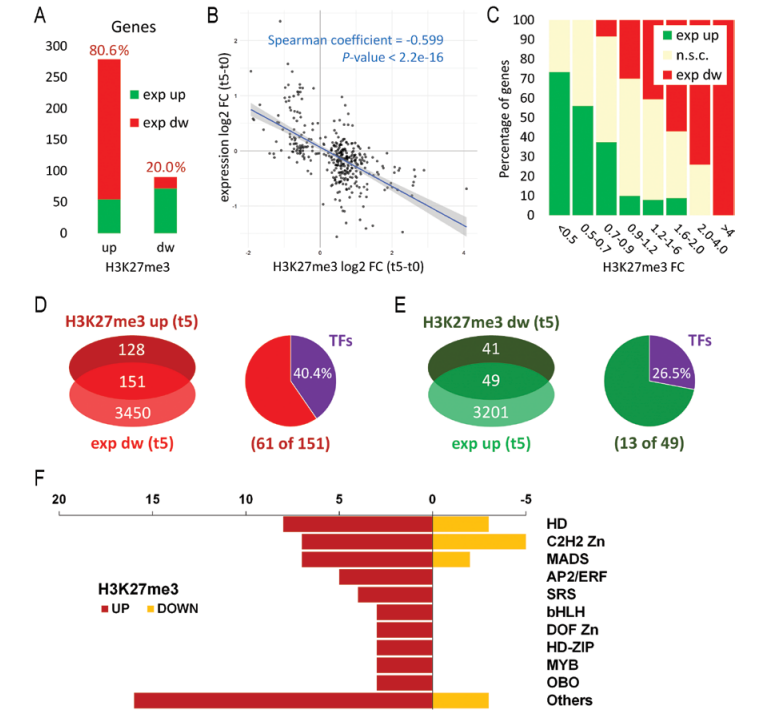
图2. 早期花发育阶段全基因组水平H3K27me3水平的变化与基因表达水平变化的相关性。A-F,ChIP-seq和RNA-seq的相关分析。
③ PRC2复合体能够在靶基因位点加载H3K27me3,PRC2家族蛋白功能缺失突变体具有花分生组织原基增大、花分生组织干细胞池的保持时间增长和干细胞活性延长的特性。
PcG功能缺失突变体emf2-10 vrn2-1 (ev) 和clf-28 swn-7 CLF-GR (iCLF)具有花器官显著增多、第五轮花器官的出现以及短棒状角果的表型。Ralf Mueller-Xing小组同时发现PcG功能缺失突变体的表型与clavata(clv)突变体的表型类似(图3)。
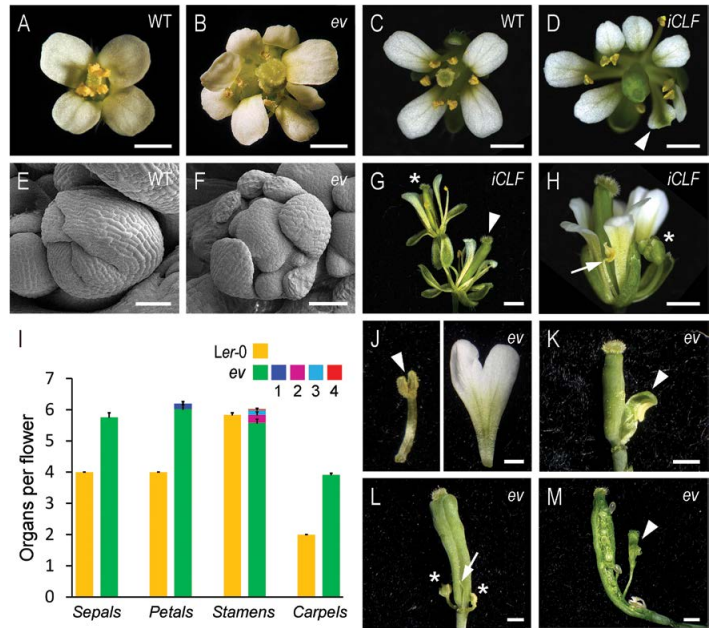
图3. PcG功能缺失突变体emf2-10 vrn2-1 (ev) 和clf-28 swn-7 CLF-GR (iCLF)的表型。WT为野生型对照。
RNA原位杂交结果表明PcG功能缺失突变体ev背景下CLV3的表达区域扩大同时表达时间延长,这与ev突变体中花分生组织干细胞池的保持时间增加和干细胞活性延长相一致。然而ev背景下WUS::GUS的表达范围与表达时间与野生型相比均减小。clv3与ev的三突变体的心皮数目正好是clv3单突变体和ev双突变体心皮数目的叠加,表明PcG调控花分生组织大小和干细胞池的命运与CLV3信号途径是两个平行的调控途径(图4)。
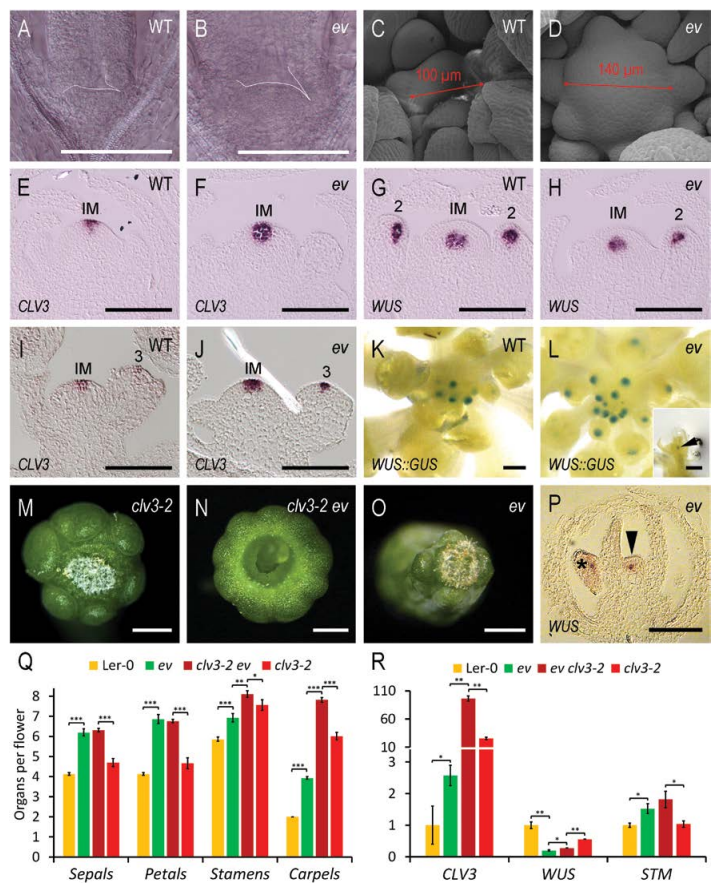
图4. PcG功能缺失突变体ev与clavata(clv)突变体的遗传互作分析。A-D,ev与野生型分生组织大小比较;E-J,CLV和WUS基因RNA原位杂交;K-L,WUS::GUS表达分析;M-O,clv3和ev心皮数比较;P,ev背景下WUS原位杂交;Q-R,ev和clv3遗传互作分析。
⑤ PcG蛋白通过表观遗传途径沉默花发育ABCE功能基因的上游抑制子AGL24和分生组织干细胞调控因子STM进而决定花分生组织干细胞命运的中止。
在组蛋白修饰和基因表达水平AGL24和STM都受PcG家族蛋白的调控,AGL24过表达株系具有与PcG功能缺失突变体ev类似的花分生组织增殖的表型,ev agl24三突变体能够显著抑制ev的花器官增殖的表型,同时发现AGL24的调控作用是通过抑制下游AP1、PI、AG 和SEP3表达而实现的。干细胞调控因子WUS和STM同时受PcG调控,这两个原件调控活性改变也是PcG突变体背景下花分生组织干细胞池无法中止的主要原因(图5)。
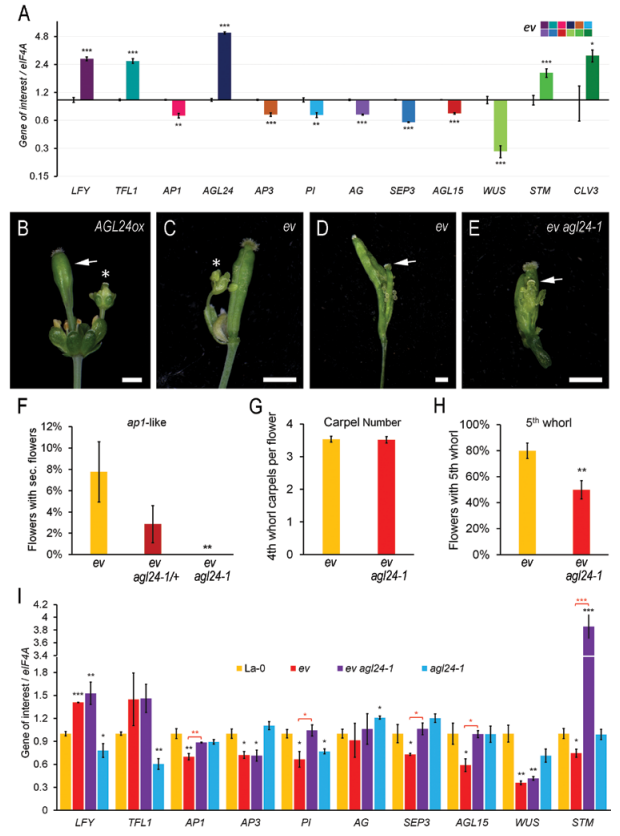
图5. PcG蛋白通过表观遗传途径沉默花发育ABCE功能基因的上游抑制子AGL24和分生组织干细胞调控因子STM进而决定花分生组织干细胞命运的中止。A,ev背景下成花调控基因的表达;B-I,ev和AGL24的遗传互作分析。
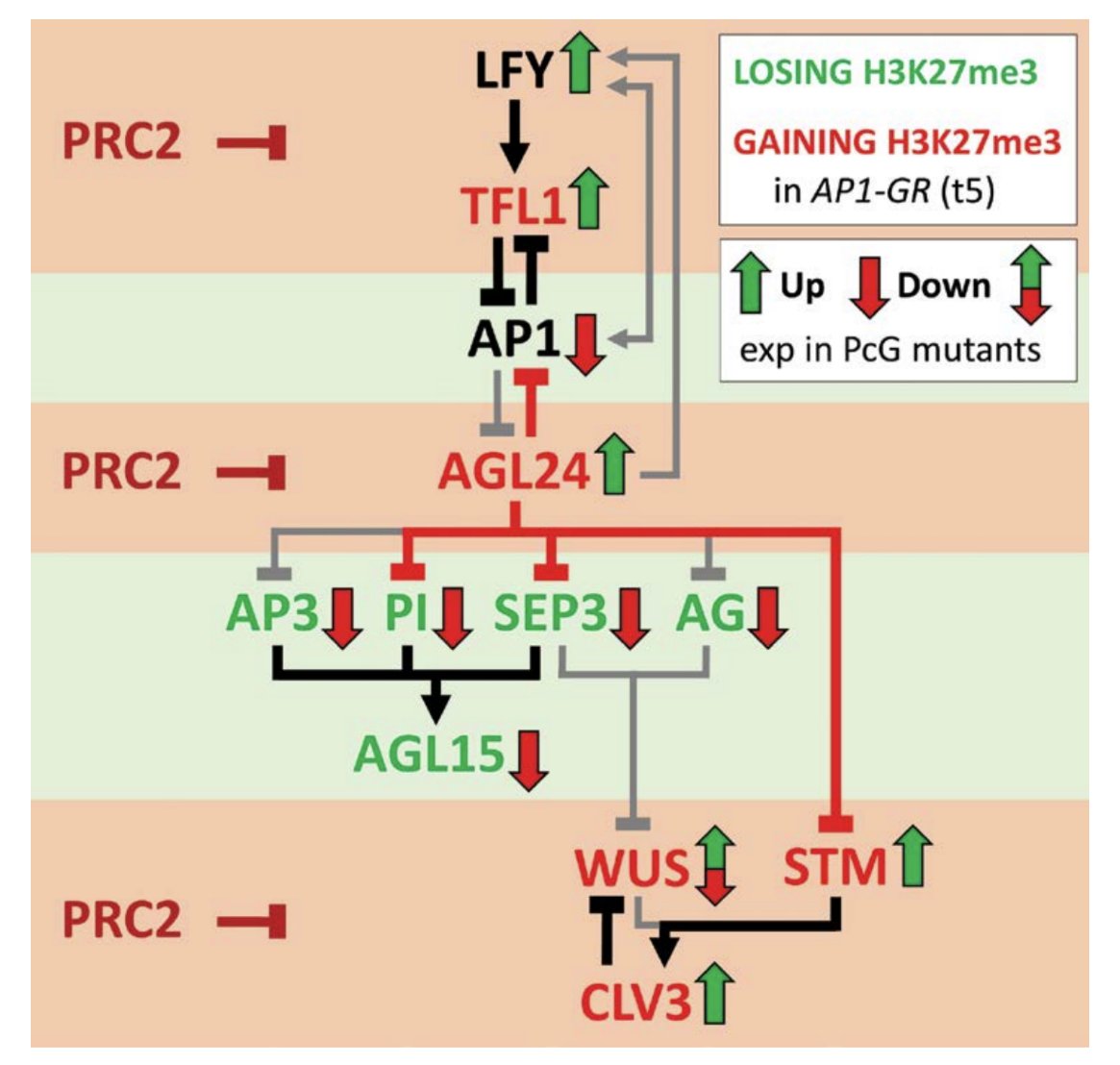
⑥文章最后提出PRC2介导的成花相关转录因子表观遗传调控网络模型,对PcG蛋白在花发育的功能提出了新的见解,即PcG蛋白不仅可以直接抑制其靶基因的表达,还可以在转录因子构建的基因表达调控网络中通过抑制转录抑制因子的表达间接促进基因表达,进而调控早期花发育(图6)。
该研究论文通讯作者为Ralf Mueller-Xing,我园邢倩副研究员为共同通讯作者。东北林业大学的博士和硕士研究生主要参与了研究工作。Journal of Experimental Botany为中科院1区Top期刊,2021-2022年影响因子为7.3。该论文全文链接https://doi.org/10.1093/jxb/erac013。
团队带头人Ralf Mueller-Xing博士为德国籍,博士毕业于德国杜塞尔多夫大学,先后在英国爱丁堡大学、德国马普所进行博士后研究,获得欧盟玛丽居里项目资助在杜萨尔多夫大学独立研究。自2015年9月来到东北林业大学,受聘教授、博士生导师并以“5211”“杰出青年学者”资助为平台组成研究团队、建立实验室,2021年9月入职庐山植物园。Ralf Mueller-Xing有数十篇高影响因子及高引用论文发表,论文他引次数超过1300次,其中有作为第一、共同作者的影响因子超过10.0期刊论文4篇,其中一篇入选The Plant Cell杂志封面文章,有超过6年以上作为教授、博士生导师及科研团队负责人的工作经验。同时还主持、结题过多项国家自然科学基金项目、省部级科研项目以及欧盟Marie-Curie、德国DAAD的科研项目。




